V ČLÁNKU SA DOZVIETE:
1. V ČOM JE ROZDIEL MEDZI ORGANICKOU A ANORGANICKOU FORMOU JÓDU
2. PREČO ZARADUJEME JÓD V SOLI MEDZI ANORGANICKÉ (NEŽIVÉ) LÁTKY
3. ŽE JE MOŽNÉ AJ V LABORATORIU VYTVORIŤ ORGANICKÚ (ŽIVÚ) ZLÚČENINU
4. PREČO SÚ ORGANICKÉ ZLÚČENINY LEPŠIE
5. PREČO SA AJ V MORSKEJ RIASE NACHÁDZA JÓD V ANORGANICKEJ (NEŽIVEJ) FORME
6. PREČO SÚ PRODUKTY JODA ORGANIKA® JEDINEČNÉ
V praxi sa často stretávame s nejasnosťami okolo anorganickej a organickej formy jódu. Vrátime sa preto k základom anorganickej a organickej chémie a schematicky rozoberieme rozdiely vo fyzikálnych, chemických i biologických vlastnostiach týchto foriem jódu.
ANORGANICKÁ FORMA JÓDU
HALOGÉNY

Jód spolu s ďalšími prvkami, ktorými sú: fluór, chlór, bróm a rádioaktívny astát patria do skupiny Halogénov. Halogény sa nachádzajú v 17. skupine periodickej sústavy prvkov. Vo svojich atómoch majú sedem valenčných elektrónov, všetky sú nekovy. Halogény sa za bežných podmienok vyskytujú ako dvojatómové molekuly X² v ktorých sú atómy viazané jednoduchou nepolárnou väzbou. Všetky halogény sú toxické. Jód ako halogén je tmavosivá tuhá kryštalická látka, ktorá sublimuje. Pary jódu sú fialové a toxické. Atómy halogénov majú veľké hodnoty elektronegativity.
ZLÚČENINY HALOGÉNOV
Medzi najvýznamnejšie zlúčeniny halogénov patria halogenovodíky, halogenidy, oxidy, kyslíkaté kyseliny a ich soli.
Väčšina halogénov je rozpustná vo vode. Halogény sa v prírode vďaka svojej reaktívnosti nevyskytujú voľné. Vyskytujú sa viazané v halogenidoch. Soli halogenovodíkových kyselín sa nazývajú halogenidy obsahujúce anión X-. Sú to dvojprvkové zlúčeniny halogénov s prvkami s menšou hodnotou elektronegativity. Ich názvy sa tvoria príponou -id; chlorid, fluorid, bromid, jodid.

Jodid je soľ kyseliny jodovodíkovej (HI). Najznámejším zástupcom je jodid draselný (KI). Nositeľom účinku je jodidový ión. Jód v ňom zaujíma podobu iónu I-. Jodid draselný (KI) je anorganická zlúčenina jódu a draslíka. Táto biela soľ je komerčne najvýznamnejším jodidom, v roku 1985 predstavovala ročná svetová výroba približne 37 tisíc ton.
Pretože je jodidový ión slabým redukčným činidlom, I- so silnými oxidačnými činidlami (napr. chlórom) ľahko oxiduje na jód: 2 KI (aq) + Cl2 (aq) → 2 KCl + I2 (aq) Táto reakcia sa využíva pri izolácii jódu z prírodných zdrojov. Jodid draselný je oxidovaný aj vzduchom, ako možno dokázať pozorovaním fialového extraktu, oplachu starej vzorky jodidu draselného dichlórmetánom.
ORGANICKÁ FORMA JÓDU
Rozdelenie chémie na anorganickú a organickú má historické dôvody. V minulosti sa chemické zlúčeniny rozdeľovali podľa pôvodu na anorganické (súvisiace s neživou prírodou) a organické (súvisiace so živou prírodou – rastlinné a živočíšne). Názov organickej chémie vyplynul z predstavy, podľa ktorej organické zlúčeniny môžu vznikať len v bunkách živých organizmov. Ešte v prvej polovici 19. Storočia sa vedci domnievali, že na tvorbu organických zlúčenín je potrebná tzv. životná sila (z latinského vis vitalis), a preto ich nie je možné pripraviť v laboratóriu. Túto predstavu vyvrátil nemecký chemik F. WOHLER, ktorý ako prvý pripravil organické zlúčeniny v laboratóriu.

Organická chémia je chémia zlúčenín uhlíka. Molekuly organických zlúčenín sú zložené z atómov pomerne malého počtu prvkov. Okrem uhlíka je to najmä vodík, ktorý je prítomný takmer vo všetkých organických zlúčeninách, kyslík a dusík. Tieto tri prvky niekedy označujeme ako organogénne prvky. V organických zlúčeninách sa často vyskytujú aj halogény, medzi ktoré patrí jód.
Organické zlúčeniny majú na rozdiel od anorganických odlišnú štruktúru ale aj odlišné fyzikálne, chemické i biologické vlastnosti, ktoré vyplývajú z osobitného postavenia uhlíka v periodickej sústave prvkov oproti ostatným prvkom.
Uhlík má v periodickej sústave prvkov výnimočné postavenie. Ako jediný z prvkov je schopný vytvárať obrovské množstvo rozmanitých zlúčenín od najjednoduchších s jedným atómom uhlík a ž po veľmi zložité, obsahujúce viac ako 100 miliónov atómov uhlíka (napríklad DNA).
Existencia veľkého množstva organických zlúčenín je daná schopnosťou atómov uhlíka takmer neobmedzene sa vzájomne spájať a tvoriť stabilné reťazce. Atómy uhlíka vytvárajú medzi sebou pevné kovalentné väzby.
Atómy uhlíka viazané v zlúčeninách nemajú voľné valenčné elektrónové páry ani orbitály. V jeho valenčnej vrstve sa nachádzajú štyri elektróny, pričom všetky sa podieľajú na tvorbe chemických väzieb (väzbové elektróny) – atóm uhlíka je v organických zlúčeninách štvorväzbový. Uhlík má pre reťazenie „výhodnú“ hodnotu elektronegativity. Elektronegativita uhlíka(2,55) leží približne v polovici intervalu medzi elektornegativitou francia(0,7) a fluóru (4,0). Kým prvky s väčšou hodnotou elektronegativity majú snahu sa redukovať (prijímať elektróny), prvky s menšou hodnotou elektronegativity sa ľahko oxidujú (odovzdávajú elektróny). Preto reťazce tovrené takýmito prvkami nevznikajú alebo sú v porovnaní s uhlikovými reťazcami menej stabilné.
V organických zlučeninách prevládajú kovalentné väzby, teda také, v ktorých dva navzájom sa viažuce atómy zdieľajú spoločnú dvojicu elektrónov. Dva atómy môžu mať spoločných aj viac väzbových elektrónových párov.
Organické zlúčeniny sa rozdeľujú do dvoch veľkých skupín uhľovodíky a deriváty uhľovodíkov. Uhľovodíky sú základné organické zlúčeniny obsahujúce len uhlík a vodík. Deriváty uhľovodíkov sú odvodené od základných uhľovodíkov a okrem uhlíka a vodíka obsahujú aj iné prvky (halogény, dusík, kyslík, a pod.). Atómy týchto prvkov viazané v organických zlúčeninách nazývame heteroatómy.
V organickej chémii existuje veľké množstvo rozmanitých reakcii. Platia pre ne tie isté zákonitosti ako pre reakcie anorganických zlúčenín, v dôsledku odlišnej a zložitejšej štruktúry majú ale odlišný priebeh. Všeobecne možno povedať, že reakcie organických zlúčenín prebiehajú pomalšie ako reakcie zlúčenín anorganických. Niektoré z nich možno uskutočniť len pri určitých teplotách, tlakoch alebo za použitia katalyzátora. Priebeh reakcií je veľmi zložitý a často pri nich vzniká pestrá zmes rôznych produktov. Premena reaktantov na produkty nie je jednoduchá. Uskutočňuje sa cez niekoľko čiastkových krokov, ktoré zahŕňajú tvorbu prechodových komplexov a tiež rôznych reakčných medziproduktov.
JODA ORGANIKA®.

Je známe, že v prírode sa jód nachádza prevažne v anorganickej forme ako stopový prvok. Organická forma jódu je v prírode vzácna, jej najväčším zdrojom sú morské ryby a ich produkty. Organická forma jódu predstavuje väzbu anorganického jódu na organické látky, na ktoré sa jód viaže kovalentnou väzbou. Zvláštnosťou vzniku organickej formy jódu u rýb je ich neobvyklý enzymaticko-metabolický systém a zaujímavé vnútorné prostredie, pomocou ktorého morské ryby sú schopné viazať anorganický jód z morskej vody na voľné väzby nenasýtených mastných kyselín, ktoré vlastne produkujú. Takýto organický jód odporúča používať väčšina odborníkov, je ľahko vstrebávateľný a metabolizovaný organizmom oproti anorganickej forme jódu, ktorá nielen, že sa ťažko vstrebáva a metabolizuje, ale vyvoláva aj rôzne nežiaduce účinky, vrátane alergických reakcií.
Nastavením príslušných parametrov, podmienok a prostredia, skúmania reakčných schopností anorganickej formy jódu s organickými látkami a analýzou získaných výsledkov sme vypracovali technológiu a realizovali prípravu novej organickej formy jódu.
POROVNANIE ANORGANICKEJ FORMY JÓDU (JODIDY - VYRÁBANÉ Z MORSKÝCH RIAS) A ORGANICKEJ FORMY JÓDU OBSIAHNUTEJ VO VÝŽIVOVOM DOLNKU JODA ORGANIKA ®
Morské riasy ako bielkoviny rastlinného pôvodu sa vyskytujú v moriach a oceánoch, kde existujú v symbióze s anorganickou formou jódu, ktorá sa nachádza v morskej vode vo forme jodidov. V tomto prostredí nie sú vytvorené podmienky kovalentnej väzby anorganickej formy jódu s atómom uhlíka tejto bielkoviny, preto ani v tomto prípade nemôžeme hovoriť o organickej forme jódu. Prítomnosť jódu v morských riasach môže byť iba v anorganickej forme, ktorú predstavujú jodidy.
Výživový doplnok JODA ORGANIKA® je charakterizovaný ako makromolekulárno-organicko-jódový komplex s rozsiahlou štruktúrou a dlhými uhľovodíkovými reťazcami, do ktorých je jód včlenený kovalentnou väzbou na uhlík s voľnými väzbami.

POROVNANIE VÄZBOVÝCH SCHOPNOSTÍ ANORGANICKEJ A ORGANICKEJ FORMY JÓDU
Anorganická forma jódu - jodid draselný, ktorý vo svojej molekule obsahuje jeden atóm draslíka a jeden atóm jódu. Pôvodne atóm draslíka je nabitý kladne, predstavuje katión a atóm jódu má záporný náboj a predstavuje anión. Ich spojením, iónovou väzbou, typickou pre anorganické zlúčeniny vzniká jodid draselný. Molekula jodidu draselného je elektricky neutrálna, to znamená, že jód v tejto forme nemá žiaden elektrický náboj, preto nemôže byť ani biologicky aktívny.
Organická forma jódu - aktívna forma jódu, kde atóm jódu ma elektrický náboj a schopnosť väzby s podobne nabitými látkami, to znamená, že nie je neutrálny a tým pádom je aktívny.
Porovnaním s inými produktmi, nová organická forma jódu vo výživových doplnkoch rady JODA ORGANIKA®, neobsahuje žiadne zdraviu škodlivé látky. Týmto sa nová organická forma jódu vo výživových doplnkoch rady JODA ORGANIKA® zaradila medzi jedinečné produkty účinné pri prevencií a prinavrátení priaznivého zdravotného stavu pri ochoreniach spôsobených narušením hladiny jódu v organizme.
Veľkou prednosťou novej organickej formy jódu vo výživových doplnkoch rady JODA ORGANIKA® oproti doposiaľ používaným je to, že štruktúra makromolekulárno-organického komplexu je organizmom veľmi dobre prijímaná a vstrebávaná, tak ako je to u iných produktov organického pôvodu, či už ide o bielkoviny, sacharidy, lipidy a iné.
 Účinnosť a neškodnosť výživových doplnkoch rady JODA ORGANIKA® bola potvrdená aj v klinickej štúdií, v ktorej boli zaznamenané výlučne pozitívne výsledky, vrátane dobrej znášanlivosti a tolerancie, bez akýchkoľvek vedľajších účinkov. Vo všetkých sledovaných prípadoch došlo k výraznému zlepšeniu zdravotného stavu.
Účinnosť a neškodnosť výživových doplnkoch rady JODA ORGANIKA® bola potvrdená aj v klinickej štúdií, v ktorej boli zaznamenané výlučne pozitívne výsledky, vrátane dobrej znášanlivosti a tolerancie, bez akýchkoľvek vedľajších účinkov. Vo všetkých sledovaných prípadoch došlo k výraznému zlepšeniu zdravotného stavu.
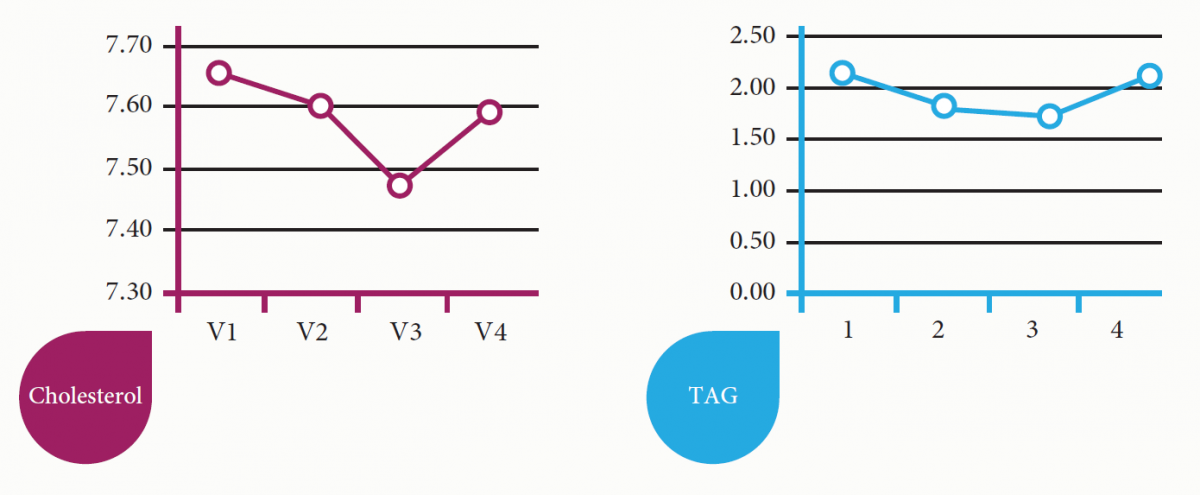
Indikácie: zlepšenie zdravotného stavu pri poruchách hormonálnej činnosti, centrálno-nervového, alebo srdcovo-cievneho systému. Pri sledovaní biochemických ukazovateľov bola zaznamenaná normalizácia hodnota glukózy, cholesterolu, hormónov štítnej žľazy, hormonálnych porúch žien spôsobených narušením menštruačného cyklu.
Naše skúsenosti potvrdzujú tieto údaje, lebo organizmus dlhodobo túto dávku toleruje bez akýchkoľvek vedľajších účinkov. Vychádzajúc z prezentovaného sme toho názoru, že nová organická forma jódu vo výživových doplnkoch rady JODA ORGANIKA®, svojim zložením, štruktúrou, účinkom sa ukázala vhodným širokospektrálnym prostriedkom pri normalizácií hladiny jódu v organizme a svojimi parametrami jednoznačne prevyšuje často neúčinné prípravky, ktoré sa na našom trhu objavujú.
Literatúra:
1./ Behrouzian R., Aghdanyi N.,: FAST MEDITERR HEALTH J. 10(2004 s. 921
2./ Borkovcova I., Řehuřkova I., : In Výživa a zdravie, 5 (2000) s. 134 – 135
3./ Boyages S.C.: In J.clin. Endocrinol. Metab, Clinical review 3 (1993) s. 587 -591
4./ Brown –Grant K.: Physiol Rev. 41 (1961) s. 189
5./ CERTEX, Cetrifikát č. 060/2010/N zo dňa 13.10.2010
6./ Delange F., Benka G., Canon Ph.: In European J. of Endocrinology 136(1997) s. 180-187
7./ Delange F., Thyroid International 3 (1994) s. 98 – 123
8./ Dvořák J.,: Serifa, 2002 s. 123
9./ Ferienčík M., Škarka B., Novák M., Turecký L., Biochémia, Bratislava (2000) s. 637-767)
10./ Golkowski F., at all: Eur J. Nutr. 46 (2007) s. 251
11./GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemistry of the Elements. Oxford, UK : Pergamon Press, 1984.
12./ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990
13./ Guy Abraham. The Wolff-Chaikoff Effect: Crying Wolf?. The Original Internist, 2005, s. 112-118.
14./ Hrnčiar J., Izakovič V., Langer P.: Klinická endokrinológia, Martin, Osveta (1982) s. 129 -211
15./ Israil L., Hajji O., Grefft – Alami A.: Proc. Asco 4 (1985) s. 58
16./ Kajaba I., Šimončič R., Gimter E.: In Výživa a zdravie 2 (1999) s. 25 -29
17./ Karlson P., Gerok W., Gross W., : Pathobiochemie, Praha (1987) s. 175 – 194, 266 – 277
18./ Klebanoff S.J.: J. Exp. Med 126 (1967) s. 1063
19./ Klimo F.: Všeobecné lekárstvo 3. Vyd., Martin, Osveta (1990) s. 871
20./ Kmeťová, Skoršepa, Mačko, Chémia pre 2. ročník gymnázia so štvorročným štúdiom, 1. vyd. Bratislava: Expol Pedagogika s.r.o., 2012. ISBN 978-80-8091-271-0
21./ Kordáč V.: In Lekárske listy 25(1999) s. 1-2
22./ Langer P., Sigmuntová V., Kaplanová V.: In Bratislavské listy 11(1995) s. 613 – 616
23./ Lanmger P.: In Lekárske listy 4 ( 1995) s. 183 – 191
24./ Leroy G. Wade, Organic Chemistry, 5th ed., pp. 871-2, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. ISBN 978-0-130-33832-7
25./ Ma F., Zhao W., Kudo M., Aoki K., Misumi J.: Toxicol in Vitro 16 ( 2000) s. 531
26./ Marani L., Venturi S., Masula R.: Isr. J. Med. Sci. 21( 1985) 864
27./ March Jerry, Advanced Organic Chemistry, 4th ed., pp. 670-1, Wiley, New York, 1992. ISBN 0-471-60180-2
28./ McCance; Huether. Pathophysiology: The biological basis for disease in Adults and Children. 5th Edition. Elsievier Publishing
29./ Mc Ginness J.E., Grossie B., Proctor P.H.: Physiological Chemistry and Physics and Medical 18 (1986) s 17 – 24
30./ Nemec J., Zmrazil V., Vaňa S.: Avicenum, Praha (1991) s. 138 – 139
31./ Nemeth Š., Podoba J.: In Bratislavské lekárske listy 1 ( 1995) s. 13 – 21
32./ Oravec S., Oravec D., Dielplinger H.: In Vnitřní lékažství 1 (1998) s. 8 -12
33./ Patrick I.: Altern. Med. Rev. 13(2008) s. 116
34./ Phyllis A. Lyday "Iodine and Iodine Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim
35./ Podoba J.: In Recipe 3-4 (1999) s. 72-77
36./ Spitzweg C., Joba W., Eisenmenger W., Heufelder A.E.: J. Clin. Endocrinol. Metab. 83 (1998) s.1746
37./ Stoddard F.R., Brooks A.D., Eskin B.A., Johannes G.J.: International Journal of Medical Science 5 (2008) s. 189
38./ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960
39./ Venturi S., Venturi M.: Nutrition, 25 (2009) s. 977 – 979
40./ Venturi S., Venturi M., Cimini D., Arduini C., Venturi M., Guidi A.: Europ. J. Cancer. Prev. 2 (1993) s. 17
41./ Vohlídal, Jiří; Štulík, Karel; Julák, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
42./ Witt E.H., Reznick A.Z., Vigule Ch.A.: J. Nutr. 122 (1992) s. 766 – 773
43./ Zmrazil V., Čeřovská J., Bílek R.: In Bratislavské lekárske listy 11 ( 1995) s. 609 -613
44./ Youngson R.: Antioxidanty cesta ke zdraví, Brno (1998) s. 42 – 43
45./ Úradný vestník EÚ L 276, Smernica rady ES č. 31990 L 0496 zo dňa 6.10.1990 určenie denných dávok minerálov a vitamínov
46./ Úradný vestník EÚ L 279/13, Nariadenie komisie EÚ č. 957/2010 zo dňa 22.10.2010 o povolení určitých zdravotných tvrdení o potravinách, ktoré odkazujú na zníženie rizika ochorenia a na vývoj a zdravie detí
47./ Úrad verejného zdravotníctva SR, Rozhodnutie č. OHVBPKV/5661/2010 zo dňa 20.8. 2010
Externý odkaz
World Health Organization's guidelines for iodine prophylaxis following a nuclear accident




